
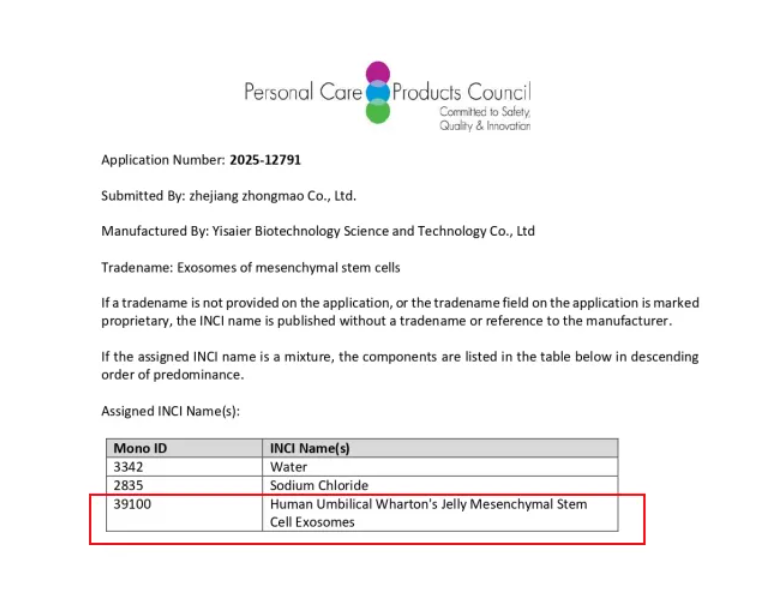
2025年9月11日,陕西医赛尔生物科技有限公司迎来重大里程碑——其自主研发的外泌体原料成功完成美国FDA II型药物主文件(DMF)备案(备案号:042249),并同步获得国际化妆品原料命名(INCI)备案(备案编号:39100)。此举标志着医赛尔成为中国第五家公开披露完成该项“双备案”的外泌体企业,不仅彰显了其技术实力与质量管理体系的国际认可,更为公司拓展全球医药及化妆品市场奠定了坚实基础。

9月11日,陕西医赛尔生物科技有限公司宣布,其核心产品外泌体原料已正式通过美国食品药品监督管理局(FDA)的II型药物主文件(DMF)备案,并同时完成国际化妆品原料命名(INCI)备案。这一成果不仅是企业自主创新能力的体现,更是中国外泌体领域国际化进程中的重要突破。
FDA DMF备案是国际药品注册与监管体系中的关键环节,尤其II型备案针对原料药、中间体及药物成分,要求企业提交详尽的生产工艺、质量控制、稳定性研究等核心技术资料,供FDA审评存档。医赛尔此次成功备案,意味着其外泌体原料在纯度、活性、一致性等方面已达到国际规范要求,可为全球创新药企在外泌体药物开发中提供合规且可靠的原料支持。

同步获得的INCI备案,则为企业打开了国际化妆品市场的大门。INCI作为全球化妆品原料命名的权威标准,其备案成功意味着该原料可依法用于化妆品中,并符合北美、欧盟等多地法规要求。这不仅提升了产品在国际市场上的可信度,也为医赛尔与全球化妆品企业的合作提供了便利。



医赛尔生物科技负责人表示:“双备案的完成是我们研发与质量体系建设的重要成果。外泌体作为新兴的生物材料,在药物递送、再生医学、功能性护肤品等领域具有广阔前景。此次备案通过,将极大推动我们与国际药企、妆企的深度合作,加速外泌体技术的产业化与全球化应用。”

据悉,医赛尔生物科技一直致力于外泌体技术平台的构建,已建立包括提取、纯化、表征、制剂在内的完整工艺体系,可为制药、化妆品及科研机构提供高标准的外泌体原料与定制化解决方案。此次双备案的达成,不仅是企业技术实力的体现,更是其国际化战略推进的关键一步。
行业专家指出,随着外泌体技术在精准医疗和美容健康领域的应用不断深入,具备国际资质的企业将更具竞争优势。医赛尔此次获批,不仅提升了中国外泌体行业的国际能见度,也为国内同类企业走向全球提供了可借鉴的路径。
未来,医赛尔将继续加大研发投入,深化与国际伙伴的合作,推动外泌体技术在多领域的创新应用,为全球生物医药与化妆品行业的发展注入新的活力。

相关链接:
DMF:
美国药物主文件(DrugMasterFile,简称DMF)是由药物制造商、药物成分供应商或包装材料供应商等提交给美国食品药品监督管理局(FDA)的机密文件。DMF注册通常包含有关药物的化学、制造和控制信息,以及其他与药物质量和安全性相关的数据。DMF的目的是向FDA提供关于药物成分、制造过程、质量控制和标准等方面的详细信息,以支持申请者在提交新药申请(NDA)、生物制品许可申请(BLA)或通用药物申请(ANDA)时的文件。包括五类:I型,生产地点和厂房设施、人员(已取消);II型,中间体、原料药和药品;III型,包装物料;IV型,辅料、着色剂、香料、香精及其它添加剂;V型,非临床数据资料和临床数据资料。
INCI:
INCI(International Nomenclature Cosmetic Ingredient),又称国际化妆品原料,由国际命名委员会(InternationalNomenclature Committee, INC) 审定和分配,并由个人护理产品委员会(PCPC)在《国际化妆品成分词典和手册》中发布,是国际公认的识别化妆品成分的统一、系统的名称。INCI清单中有16000多种成分,是化妆品和个人护理产品中使用的最全面的成分清单。